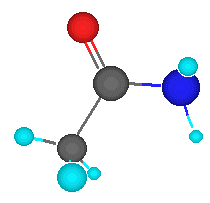
Son todos aquellos compuestos que resultan de la
combinación de los elementos químicos carbono e hidrógeno. Los
hidrocarburos surgen en la naturaleza y por ende son los principales
compuestos de la química orgánica, siendo sus máximos representantes el petróleo
(hidrocarburo en estado líquido)
y el gas natural (hidrocarburo en estado gaseoso).
Son todos aquellos compuestos que resultan de la
combinación de los elementos químicos carbono e hidrógeno. Los
hidrocarburos surgen en la naturaleza y por ende son los principales
compuestos de la química orgánica, siendo sus máximos representantes el petróleo
(hidrocarburo en estado líquido)
y el gas natural (hidrocarburo en estado gaseoso).
Estos compuestos se producen durante millones de años en
la profundidad de la tierra y
son provenientes de la descomposición de plantas y animales de épocas antiguas.
Los hidrocarburos se componen de átomos de carbono
que se entrelazan con átomos de hidrógeno y se dividen en dos grandes
grupos: alifáticos (alcanos, alquenos y alquinos) y aromáticos.
Los alcanos son aquellos que presentan enlaces
sencillos, los alquenos poseen enlaces dobles y los alquinos son los que
cuentan con enlaces triples.
Por otro lado, los hidrocarburos pueden salir al exterior
(desde el interior de la tierra) de manera natural o a través de la explotación
o perforación de sus yacimientos.
Con el pasar de los años y con el surgimiento de la
revolución industrial, los hidrocarburos tomaron muchísima importancia para
el desarrollo
económico, dado que una vez procesados, los mismos pueden dar origen a
una gran cantidad de productos que son utilizados en la cotidianidad.
 Por ejemplo, pueden ser transformados en
combustibles para generar energía y/o tener un uso industrial, para la
fabricación de diversos productos como asfalto, plásticos,
cosméticos, lubricantes de vehículos, entre otros. Incluso, el gas en su forma
natural es utilizado en el día a día de los seres humanos, para la utilización
de las cocinas y así preparar alimentos.
Por ejemplo, pueden ser transformados en
combustibles para generar energía y/o tener un uso industrial, para la
fabricación de diversos productos como asfalto, plásticos,
cosméticos, lubricantes de vehículos, entre otros. Incluso, el gas en su forma
natural es utilizado en el día a día de los seres humanos, para la utilización
de las cocinas y así preparar alimentos.
Pero, a pesar de que los hidrocarburos se presentan como
muy positivos, también tienen sus efectos negativos sobre el medio
ambiente y los humanos. Los mismos pueden ocasionar afecciones
respiratorias, llegando a generar intoxicaciones graves. Además, en el caso del
petróleo si éste es derramado por algún transporte marítimo o al ser explotado,
al entrar en contacto con el agua produce la contaminación la misma.
En otros planetas como Júpiter, Saturno, Titán y Neptuno
se han encontrado hidrocarburos que han surgido sin necesidad de que haya
habido vida para generarlos. Éstos están compuestos parcialmente por metano o
el etano.